Quimica Ley De Boyle Relacion Entre Presion Y Volumen

Química Ley De Boyle Relación Entre Presión Y Volumen Youtube A medida que la presión aumenta, el volumen ocupado por el gas disminuye. por lo contrario, si la presión aplicada disminuye, el volumen ocupado por el gas aumenta. esta relación se conoce como la ley de boyle. matemáticamente se puede expresar esta relación inversa entre presión y volumen como : o. Para los gases, la presión y el volumen son inversamente proporcionales. si mantienes todo lo demás constante y elevas la presión de un gas, su volumen dismi.
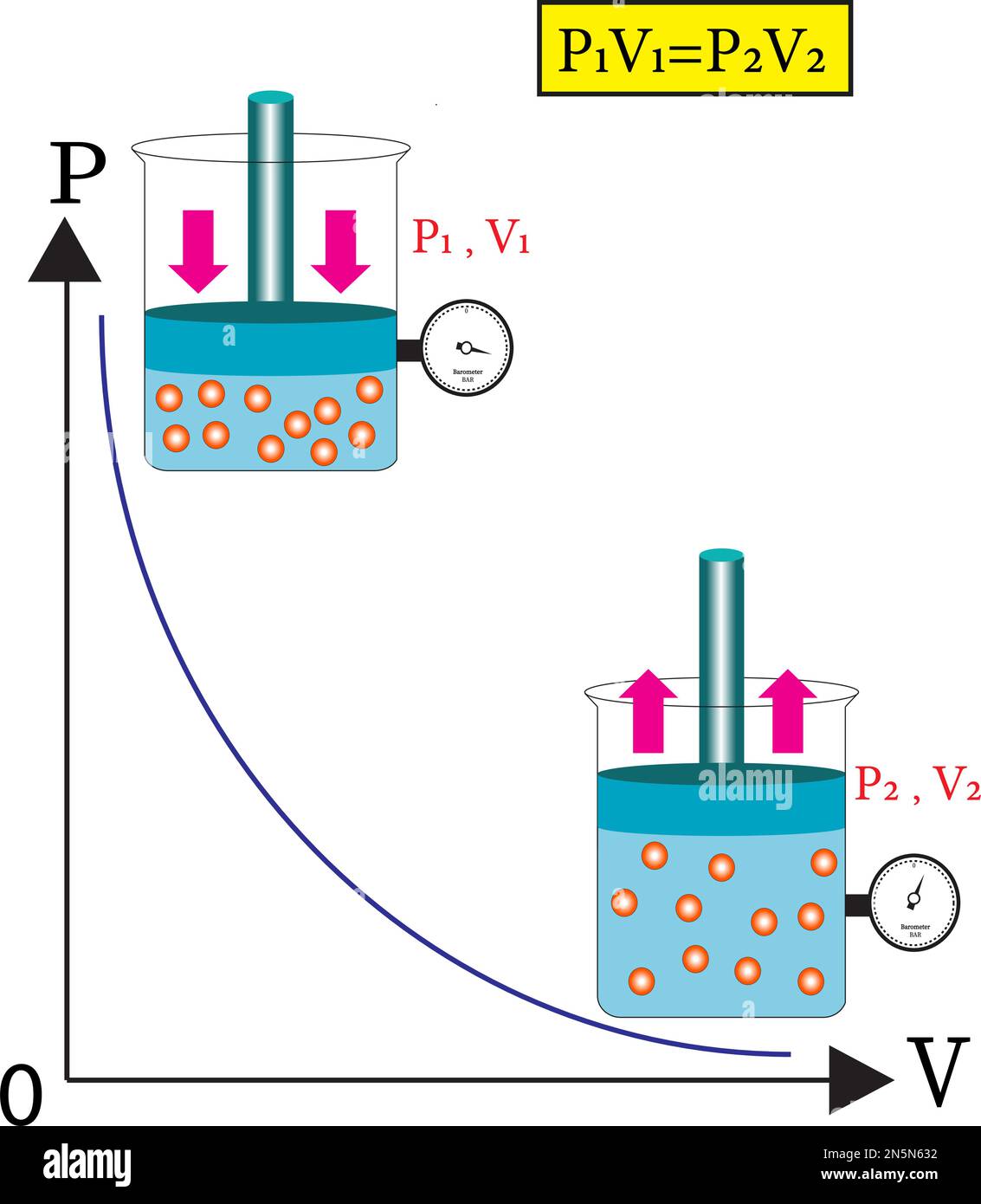
Ley De Boyle Relación Entre Presión Y Volumen De Gas Imagen Vector De Ley de boyle. la primera relación simple, referida como ley de gas, es entre la presión de un gas y su volumen. si la cantidad de gas en una muestra y su temperatura se mantienen constantes, entonces a medida que aumenta la presión de un gas, el volumen del gas disminuye proporcionalmente. matemáticamente, esto está escrito como. Podemos usar la ley de boyle para predecir qué pasará con el volumen de una muestra de gas a medida que cambiemos la presión. debido a que pv es una constante para cualquier muestra dada de gas (a t constante), podemos imaginar dos estados; un estado inicial con cierta presión y volumen (p 1 v 1), y un estado final con diferentes valores para presión y volumen (p 2 v 2). Las leyes de boyle, charles, gay lussac y avogadro se combinan en una sola ecuación que describe el comportamiento de un gas ideal: p v = n r t. donde: p es la presión, v es el volumen, n es el número de moles del gas, r es la constante de los gases ideales (0.0821 l·atm (mol·k) o 8.314 j (mol·k)), t es la temperatura en kelvin. Expresión matemática. para llegar a la expresión matemática de la ley de boyle se parte desde: v ∝ 1 p. donde indica que el volumen ocupado por un gas es inversamente proporcional a su presión. sin embargo, existe una constante que dictamina qué tan inversamente proporcional es dicha relación. v = k p. donde k es la constante de.

Ciencias 7 Química Ley De Boyle Relación Entre Presión Y Volumen Las leyes de boyle, charles, gay lussac y avogadro se combinan en una sola ecuación que describe el comportamiento de un gas ideal: p v = n r t. donde: p es la presión, v es el volumen, n es el número de moles del gas, r es la constante de los gases ideales (0.0821 l·atm (mol·k) o 8.314 j (mol·k)), t es la temperatura en kelvin. Expresión matemática. para llegar a la expresión matemática de la ley de boyle se parte desde: v ∝ 1 p. donde indica que el volumen ocupado por un gas es inversamente proporcional a su presión. sin embargo, existe una constante que dictamina qué tan inversamente proporcional es dicha relación. v = k p. donde k es la constante de. Según la ley de boyle, existe una relación inversa entre la presión y el volumen. la ley de boyle es válida solo si el número de moléculas (n) y la temperatura (t) son constantes. la ley de boyle se usa para predecir el resultado de introducir un cambio en el volumen y la presión únicamente, y solo en el estado inicial de una cantidad. Esta relación entre presión y volumen se conoce como ley de boyle, después de su descubridor, y se puede afirmar de la siguiente manera: a temperatura constante, el volumen de una cantidad fija de un gas es inversamente proporcional a su presión. esta ley en la práctica se muestra en la figura 5.3.2 5.3. 2.
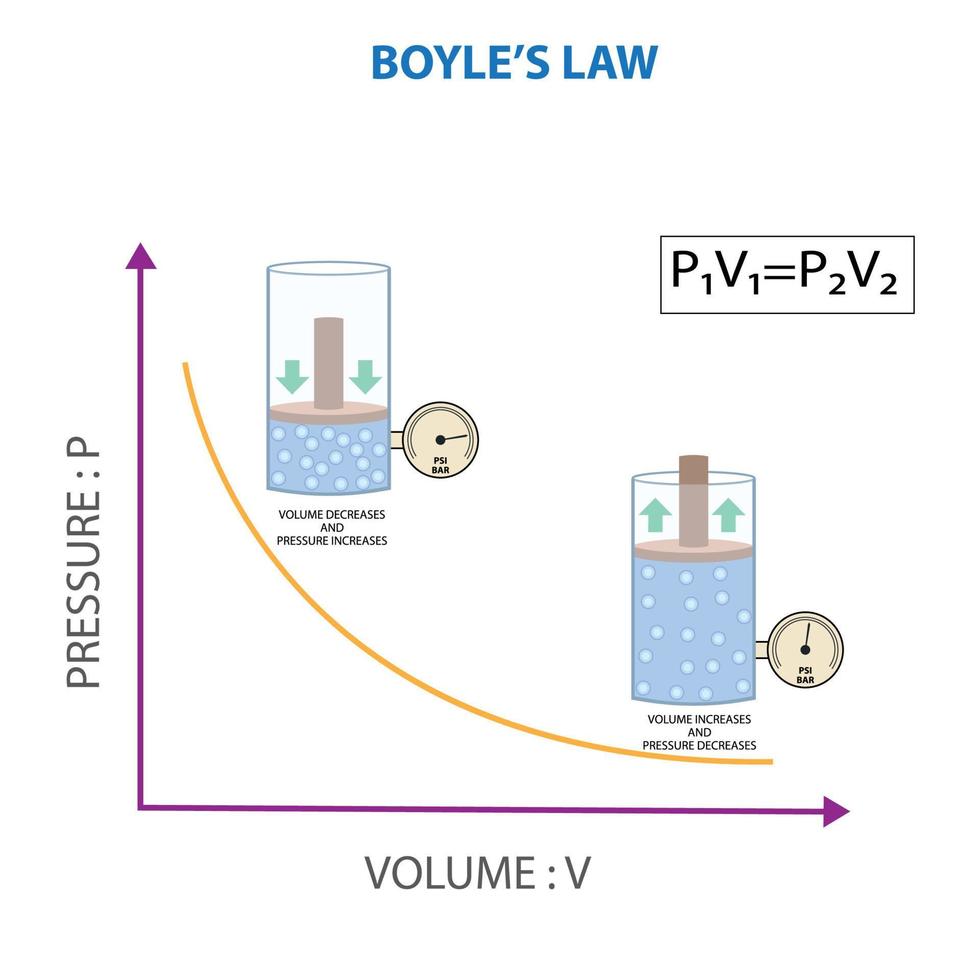
De Boyle Ley Relación Entre Presión Y Volumen De Gas A Constante Según la ley de boyle, existe una relación inversa entre la presión y el volumen. la ley de boyle es válida solo si el número de moléculas (n) y la temperatura (t) son constantes. la ley de boyle se usa para predecir el resultado de introducir un cambio en el volumen y la presión únicamente, y solo en el estado inicial de una cantidad. Esta relación entre presión y volumen se conoce como ley de boyle, después de su descubridor, y se puede afirmar de la siguiente manera: a temperatura constante, el volumen de una cantidad fija de un gas es inversamente proporcional a su presión. esta ley en la práctica se muestra en la figura 5.3.2 5.3. 2.

Gases Ley De Boyle Presión Vs Volumen P1 V1 P2 V2 O V P K Youtube

Comments are closed.